Lo studio ha evidenziato che la variazione nella scala Motor Function Measure (MFM-32) rispetto al basale (endpoint primario) è risultata significativamente superiore nelle persone trattate con risdiplam rispetto a quanto osservato con il placebo (differenza media di 1,55 punti; p = 0,0156).
Anche nella scala Revised Upper Limb Module (RULM), uno dei principali endpoint secondari, è stato registrato un miglioramento (differenza di 1,59 punti; p = 0,0028). La sicurezza di risdiplam nello studio SUNFISH è risultata in linea con il suo noto profilo di sicurezza.
Le evidenze
Dalle analisi esplorative di sottogruppo è emerso che le risposte più rilevanti nella scala MFM-32 rispetto al placebo sono state osservate nella fascia più giovane d’età (2-5 anni) (78,1% verso 52,9% hanno registrato un aumento ≥ 3 punti).
Nella fascia d’età 18-25 anni è stata evidenziata stabilizzazione della malattia (57,1% verso 37,5%, con stabilizzazione definita come un aumento ≥ 0 punti), che rappresenta l’obiettivo del trattamento nei pazienti con malattia di più lunga durata.
“Risdiplam è il primo potenziale trattamento per cui sono disponibili dati registrativi controllati con placebo in un’ampia popolazione di pazienti, compresi bambini, adolescenti e adulti”, ha dichiarato lo sperimentatore principale dello studio SUNFISH Eugenio Mercuri, Unità di Neuropsichiatria Infantile, Policlinico Gemelli, Università Cattolica di Roma. “I dati suggeriscono che risdiplam è in grado di preservare e potenzialmente accrescere l’indipendenza attraverso una migliore funzione motoria nelle persone con SMA di tipo 2 o SMA di tipo 3 non deambulanti”.
La sicurezza di risdiplam nello studio SUNFISH è risultata in linea con il suo noto profilo di sicurezza e non sono stati identificati nuovi segnali di sicurezza. Il profilo di eventi avversi si è rivelato analogo a quello del placebo. Gli eventi avversi più comuni sono stati infezioni delle alte vie respiratorie (31,7%), rinofaringite (25,8%), piressia (20,8%), mal di testa (20%), diarrea (16,7%), vomito (14,2%) e tosse (14,2%).
Mentre il tasso di infezioni delle basse vie respiratorie era simile in entrambi i bracci di trattamento (risdiplam 19%, placebo 20%), le infezioni gravi delle basse vie respiratorie hanno interessato più pazienti nel gruppo risdiplam (risdiplam 10% placebo 2%), ma sono state segnalate come non correlate al farmaco e si sono risolte senza dover modificare il trattamento in studio. Ad oggi, oltre 400 pazienti sono stati trattati con risdiplam in tutti gli studi, senza risultati di sicurezza correlati al trattamento che abbiano comportato il ritiro dei pazienti dalle sperimentazioni condotte con questo farmaco.
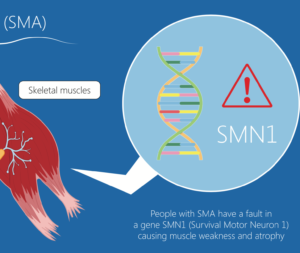
Roche guida lo sviluppo clinico di risdiplam, farmaco sperimentale somministrato per via orale, per il trattamento della SMA che interviene sullo splicing del gene SMN2 (survival motor neuron 2, fattore di sopravvivenza del motoneurone 2), nell’ambito di una collaborazione con la SMA Foundation e con PTC Therapeutics.
Risdiplam è in fase di studio in un vasto programma di sperimentazione clinica sulla SMA, i cui pazienti hanno un’età compresa tra zero e 60 anni, alcuni precedentemente trattati con terapie per la SMA. La popolazione di studio è rappresentativa dell’ampio spettro di persone affette nella realtà da questa malattia e ha lo scopo di garantire l’accesso a tutti i pazienti appropriati.
A novembre 2019, la Food and Drug Administration statunitense ha accordato a risdiplam la Priority Review (revisione prioritaria) con decisione di approvazione entro il 24 maggio 2020.