La costruzione di strategie terapeutiche basate esclusivamente sui dati di uno studio clinico controllato è un processo fondamentale ma, per certi versi, incompleto. Offre, infatti, una visione limitata su un gruppo ristretto della popolazione di pazienti; questo non permette di avere una visione completa dell’impatto e dei risultati delle terapie nel mondo reale. Le Real World Evidence possono infatti risultare particolarmente preziose perché possono rivelarsi fondamentali nella programmazione sanitaria.
Di tutto questo si è parlato in occasione del settimo Excellence Show promosso a Roma da Sics Editore nell’ambito del Festival dell’Innovazione, che culminerà il 23 marzo con la premiazione dei TOP di ciascuna delle 16 categorie che compongono i Life Science Excellence Awards. Ad approfondire il tema del “Real World Evidence: dagli insights all’azione” sono stati Viviana Ruggieri, External Relations, Market Access & Regulatory Director del Gruppo Servier in Italia; Mariangela Amoroso, Country Medical Chair Sanofi; Frederico da Silva, VP & General Manager di Gilead Sciences.
“La Real World Evidence – ha detto Viviana Ruggieri aprendo il dibattito – rappresenta uno strumento innovativo basato sulla raccolta di informazioni che riguardano la gestione globale del paziente e non solo il monitoraggio del percorso di cura di una specifica patologia”. Queste informazioni, ha spiegato la External Relations, Market Access & Regulatory Director del Gruppo Servier in Italia, “provengono da varie fonti: dalle procedure amministrative, come nel caso delle prescrizioni, dalle cartelle cliniche ma anche dagli strumenti digitali oggi sempre più a disposizione, come app o apparecchiature per il telemonitoraggio”. Secondo Ruggieri l’Italia è tra i Paesi “più avanzati” per quel che concerne la raccolta sistematica di dati “il limite che abbiamo è che questi database sono utilizzati prevalentemente in un’ottica amministrativa. Se avessimo la possibilità di metterli aa sistema in un’ottica integrata con quelli di natura più clinica e assitenziale, come è accaduto durante la pandemia da Covid-19, potremmo trarne importanti vantaggi, a cominciare dalla messa a disposizione accelerata e controllata di nuovi farmaci”.
Ad entrare nello specifico dell’utilizzo dei dati di Real World Evidence è stata Mariangela Amoroso, che ha spiegato come “già nella fase pre-registrativa la messa disposizione di queste informazione permetterebbe di integrare quella serie di dati e di risultati che arrivano dagli studi sperimentali, aiutando a comprendere l’epidemiologia, lo standard of care ma anche i bisogni non soddisfatti su cui concentrare i nostri studi”.
Nella fase post-registrativa, ha proseguito il Direttore Medico di Sanofi, “questi dati ci offrono la possibilità di avere ulteriori informazioni che possono confermare o smentire quanto emerso dagli studi sperimentali. Parliamo di dati di sicurezza ed efficacia, ma non solo. Attraverso le indagini condotte tra i pazienti e il monitoraggio del loro percorso assistenziale, possiamo infatti conoscere le preferenze dei malati, le loro esigenze, i punti di forza e quelli deboli delle loro esperienze. Aspetti che sono importanti per i pazienti, ma anche per mantenere il valore del prodotto all’interno del mercato”.
Amoroso ha poi richiamato l’attenzione della platea su come questi dati siano più che mai preziosi in un’area specifica come quella delle malattie rare: “Si realizzano le condizioni per consentire processi regolatori senza la necessità di studi randomizzati, che sarebbe difficile condurre dal momento che la popolazione di pazienti non è sufficientemente grande da rispondere ai parametri standard di uno studio clinico”.
Concordando con quanto precedentemente detto, Frederico da Silva ha evidenziato come “queste evidenze permettono di seguire il percorso sia del paziente che del prodotto, creando tantissime opportunità per quanto concerne il ciclo di vita del prodotto stesso: dallo sviluppo alla fase post approvazione e rimborso”. Il VP & General Manager di Gilead Sciences ha poi riferito che l’azienda si sta concentrando anche sulle potenzialità che queste evidenze offrono nell’ambito del pre-marketing, “perché consentono di raccogliere informazioni epidemiologiche e in merito al peso delle patologie. Ci permettono inoltre di comprendere le necessità mediche, dandoci l’opportunità di cambiare il nostro approccio allo sviluppo e di progettare in modo migliore i nostri studi clinici”.
Per Viviana Ruggieri, comunque, la Real World Evidence non può che essere e restare “integrativa rispetto alle modalità di fare ricerca che conosciamo e continuano ad essere fondanti, sia per quanto concerne il disegno che la solidità del risultato che proviene da questi studi”. “Diverso – ha però sottolineato – è intervenire con nuovi modelli in quegli ambiti dove c’è un importante e insoddisfatto bisogno di terapie, ma non ci sono i tempi né il campione sufficiente per eseguire gli studi secondo i modelli standard, caratteristiche che aumentano anche le difficoltà a definire oltre che il profilo di beneficio/rischio di un farmaco, anche del suo place in therapy”.
Questo approccio, ha detto ancora la External Relations, Market Access & Regulatory Director del Gruppo Servier in Italia, assume un ulteriore significato anche per raccogliere dati supplementari a quello degli studi tradizionali, nel post marketing, nell’ottica di una medicina sempre più personalizzata, che porti con sé un valore aggiunto rispetto al contesto in cui viene utilizzata e rispetto alle soluzioni terapeutiche già esistenti: “Utilizzare questi dati ci permette di andare incontro alle esigenze del paziente e di trovare un equilibrio tra gli investimenti compiuti dall’azienda e la sostenibilità del sistema sanitario che ha la responsabilità di offrire ai cittadini le migliori terapie disponibili”.
Ma in che modo questo nuovo approccio entra in gioco? “Le direzioni mediche, il medical affair, insieme a funzioni specifiche come quella del data scientist, sono il driver nel creare un dialogo virtuoso con i clinici, i pazienti, le istituzioni, i partner accademici e tecnologici. È infatti dall’interazione di tutte queste figure che è possibile capire quali sono le ‘evidenze’ utili per poter costruire valore e avere l’impatto che vogliamo sulle cure e i pazienti”, ha spiegato Mariangela Amoroso. Il medical affairs, in particolare, “ha la responsabilità di facilitare la raccolta di questi dati, cercando di avere uno sguardo più ampio ed olistico, dove conta non solo l’efficacia e la sicurezza, ma tutti quegli altri fattori – socio-economici, ambientali o comportamentali – che possono entrare in gioco e che diventano strategici da comprendere non solo per il clinico, ma anche in ambito regolatorio e istituzionale”, ha detto il Direttore Medico Sanofi.
Parlando del ruolo dei Real World Evidence durante la pandemia da Covid-19, Frederico da Silva ha osservato come l’emergenza abbia posto la necessità ma per certi versi anche le condizioni per trovare una soluzione che fosse la più efficace sia per i pazienti che per la sanità pubblica: “Per questo, anche se gli studi clinici controllati rimangono lo strumento essenziale per verificare l’efficacia di farmaci e trattamenti, i Real World Evidence restano uno strumento assolutamente essenziale”.
Da Silva ha ricordato come, durante la pandemia, “Gilead abbia potuto condurre corposte analisi di Real World Evidence, che hanno convolto quasi 100mila pazienti ricoverati per Covid, un numero che non sarebbe mai stato possibile raggiungere attraverso gli studi clinici controllati”.
Il VP & General Manager di Gilead Sciences ha voluto infine sottolineare come la sua esperienza al di fuori dell’Italia, “sono portoghese e ho il privilegio di lavorare in tanti Paesi anche extra Ue”, lo abbia portato a capire che “l’Italia dovrebbe essere orgogliosa dell’Aifa, che è una autorità migliore rispetto ad altre autorità simili che esistono nel mondo perché si è dotata di registri davvero all’avanguardia che forniscono dati importanti”.
Viviana Ruggieri ha convenuto sul fatto che “il sistema Italia abbia una grande ricchezza di dati”, che però devo essere sempre meglio utilizzati a vantaggio degli outcomes. “I risultati di uno studio sono basati su un gruppo di pazienti selezionati e monitorati, ma sappiamo bene che la real life è un’altra cosa e che, ad esempio, non sempre l’aderenza terapeutica è puntuale come dovrebbe essere. Il nostro Gruppo – ha spiegato – è da anni impegnato a favorire il dialogo con tutti gli stakeholder e con l’ente regolatore e sull’importanza di verificare se il paziente segue la terapia e anche se nel tempo i percorsi di cura funzionano ancora o hanno bisogno di essere rivisti”. Questo ultimo aspetto, ha fatto notare Ruggieri, è particolarmente importante nel caso delle malattie croniche, che accompagnano per tutta la vita il paziente, nel quale tuttavia, nel tempo, possono emergere comorbilità o altre condizioni che influenzano gli effetti delle terapie iniziali. “I dati Real Life permettono anche di capire se l’assistenza che il sistema mette a disposizione del paziente è realmente efficace ed efficiente, anche dal puto di vista economico. Molti sprechi o costi aggiuntivi, infatti, derivano proprio dal fatto che i pazienti non seguono correttamente le terapie o non vengono seguiti nel corso del tempo causando l’interruzione delle stesse e la relativa perdita di chance sia del paziente che del sistema che si fa carico dei relativi costi”, ha detto portavoce del Gruppo Servier in Italia.
Mariangela Amoroso ha portato l’esperienza di Sanofi, che a livello globale è dotata di uno specifico asset dedicato ai big data e utilizza l’apprendimento automatico e l’intelligenza artificiale per analizzare dati anonimizzati provenienti da cartelle cliniche. Grazie alla piattaforma Darwin, abbiamo potuto analizzare circa 400milioni di dati che stiamo mettendo a disposizione di un’altra azienda Usa, costituita da membri dell’università di Harvard, per un’analisi congiunta con i loro database. In tal modo avremo a disposizione numerose evidenze a supporto dei dossier registrativi per gli enti regolatori, in particolare Fda ed Ema. L’obiettivo di Sanofi è, dunque, lavorare con le istituzioni per fornire loro solide informazioni che possano aiutarli nel loro percorso di decisioni”.
Anche in Italia, ha aggiunto Amoroso, “siamo attivi in diversi tavoli di lavoro, per sottoporre all’attenzione dell’Aifa delle proposte concrete per quanto riguarda la presentazione e l’utilizzo di dati e dossier in una logica di collaborazione pubblico-privato che consenta di dare vita a modelli efficienti che alla fine hanno un solo scopo: migliorare le cure per i nostri pazienti”.
Per quanto riguarda Gilead, ha spiegato Frederico da Silva, “già prima del Covid avevamo costruito progetti di integrazione di varie fonti di dati e informazioni per sviluppare il nostro portfolio, ma abbiamo percepito l’esigenza ulteriore di creare un gruppo dedicato che concentrasse il proprio lavoro sull’intero ciclo di vita del farmaco utilizzando dunque le Real World Evidence nella fase pre e post rimborso”.
Gilead è inoltre impegnata a collaborare con gli enti e le autorità per “comprendere il modo migliore per generare e utilizzare queste evidenze”. Tra gli obiettivi del gruppo anche l’utilizzo di queste informazioni per “arrivare alle terapie in tempi sempre più rapidi. Il nostro intento entro il 2030 è di sviluppare 10 farmaci trasformativi per rispondere alle esigenze mediche dei pazienti e dell’intero ecosistema”.
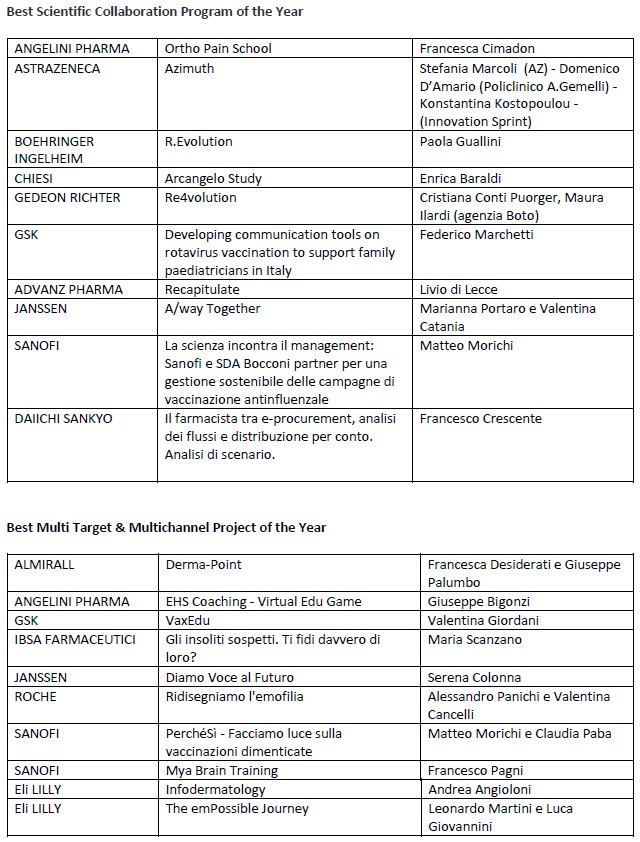
Di seguito i vincitori nelle due categorie premiate e il nome di chi ha ritirato il riconoscimento anche a nome del Team di progetto.
di Lucia Conti